Chào cả nhà “Nhật Ký Con Nít”! Hôm nay chúng ta sẽ cùng nhau khám phá một chủ đề nghe có vẻ hơi “hàn lâm” một chút, nhưng lại cực kỳ liên quan đến cuộc sống hàng ngày của chúng ta đấy. Đó là việc làm sao để biết được “độ đậm đặc” hay còn gọi là nồng độ của một dung dịch HCl. Nghe HCl có vẻ xa lạ nhỉ? Nhưng thực ra, khái niệm “nồng độ” thì lại rất quen thuộc. Bạn đã bao giờ pha nước cam chưa? Nước cam pha đặc hay pha loãng chính là nói về nồng độ đấy! Dung dịch HCl (axit clohidric) cũng tương tự. Việc để Xác định Nồng độ Của Một Dung Dịch Hcl là một kỹ thuật quan trọng trong hóa học, và hiểu về nó giúp chúng ta biết cách sử dụng hóa chất an toàn hơn, hiểu rõ hơn về những thứ xung quanh mình. Đừng lo, chúng ta sẽ “giải mã” nó một cách đơn giản và gần gũi nhất nhé!
Nồng Độ Là Gì? Tại Sao Phải Quan Tâm Đến Nồng Độ Của Một Dung Dịch, Đặc Biệt Là HCl?
Bạn cứ hình dung thế này nhé: Mẹ pha cho bạn một cốc siro dâu. Nếu mẹ cho thật nhiều siro vào ít nước, cốc nước sẽ có màu đỏ đậm và vị ngọt lịm – đó là siro nồng độ cao. Còn nếu mẹ cho ít siro vào nhiều nước, cốc nước sẽ có màu nhạt hơn và vị ngọt thanh – đó là siro nồng độ thấp. Nồng độ chính là cách nói về lượng “chất tan” (như siro, đường, muối, hoặc trong trường hợp này là HCl) có trong một lượng “dung môi” (thường là nước).
{width=800 height=319}
Trong bếp nhà mình, nồng độ nghĩa là gì?
Nồng độ xuất hiện khắp nơi trong nhà bạn. Nước muối súc miệng có nồng độ muối nhất định. Nước giặt, nước rửa chén cũng có nồng độ chất tẩy rửa khác nhau. Thậm chí, khi làm bánh, công thức yêu cầu bao nhiêu gam đường trên bao nhiêu gam bột cũng là một cách nói về nồng độ. Việc biết nồng độ giúp chúng ta sử dụng mọi thứ đúng mục đích và hiệu quả.
Tại sao phải quan tâm đến nồng độ của một dung dịch, đặc biệt là HCl?
HCl, hay axit clohidric, là một loại axit mạnh. Nó có nhiều ứng dụng, từ việc sản xuất thực phẩm (điều chỉnh độ chua), xử lý nước, cho đến các ngành công nghiệp khác. Thậm chí, trong dạ dày của chúng ta cũng có một lượng HCl rất loãng giúp tiêu hóa thức ăn! Tuy nhiên, HCl ở nồng độ cao có thể rất nguy hiểm, gây bỏng da, tổn thương mắt. Việc biết để xác định nồng độ của một dung dịch HCl là cực kỳ quan trọng để đảm bảo an toàn khi sử dụng, lưu trữ, và vận chuyển nó. Ví dụ, một sản phẩm tẩy rửa có ghi nồng độ HCl 5% sẽ ít nguy hiểm hơn nhiều so với loại 30%. Biết nồng độ giúp chúng ta đưa ra quyết định đúng đắn về cách sử dụng và các biện pháp phòng ngừa cần thiết.
Axit Là Gì? Đặc Biệt Là Axit HCl?
Trước khi tìm hiểu cách để xác định nồng độ của một dung dịch HCl, chúng ta hãy nói sơ qua về axit. Axit là một nhóm các chất hóa học có những tính chất đặc trưng. Bạn có thể nhận biết một số axit trong đời sống qua vị chua (như axit citric trong chanh, axit axetic trong giấm) hoặc khả năng làm đổi màu một số chất chỉ thị (như làm giấy quỳ tím hóa đỏ). Axit mạnh như HCl có khả năng phản ứng mạnh với nhiều chất khác, bao gồm cả kim loại và các mô sống.
HCl có ở đâu xung quanh ta?
Như đã nhắc đến, HCl tồn tại trong dạ dày chúng ta dưới dạng rất loãng để giúp phân giải thức ăn. Trong công nghiệp và đời sống, HCl đậm đặc được sử dụng rộng rãi. Chú ý nhé, đậm đặc là từ khóa quan trọng. HCl đậm đặc là chất lỏng không màu, bốc khói và có mùi sốc. Nó cực kỳ ăn mòn. Khi pha loãng với nước, nó tạo thành dung dịch HCl có nồng độ khác nhau, được sử dụng cho nhiều mục đích.
{width=800 height=1328}
Tại sao phải phân biệt axit mạnh yếu và nồng độ?
Một loại axit có thể là axit mạnh (như HCl, axit sulfuric) nhưng ở nồng độ rất loãng thì nó vẫn an toàn. Ngược lại, một loại axit yếu (như axit axetic trong giấm) nhưng ở nồng độ rất cao cũng có thể gây nguy hiểm. Nồng độ cho chúng ta biết lượng axit có trong dung dịch, còn “mạnh yếu” là nói về bản chất của loại axit đó – khả năng “phân ly” hay “phản ứng” của nó. Việc để xác định nồng độ của một dung dịch HCl giúp chúng ta biết được “có bao nhiêu” axit mạnh này trong dung dịch cụ thể mà chúng ta đang quan tâm.
Vậy Làm Thế Nào Để Xác Định Nồng Độ Của Một Dung Dịch HCl? – Những Cách Cơ Bản
Đến phần chính rồi đây! Để biết được “độ đậm đặc” của dung dịch HCl, các nhà khoa học có nhiều cách khác nhau. Với chúng ta, những người yêu thích mẹo vặt cuộc sống và muốn hiểu thêm về thế giới quanh mình, chúng ta sẽ tìm hiểu những nguyên lý cơ bản nhất, thậm chí có cách còn có thể “mô phỏng” tại nhà với những thứ an toàn hơn! Việc để xác định nồng độ của một dung dịch HCl đòi hỏi các phương pháp hóa học chính xác, nhưng nguyên lý đằng sau thì khá dễ hiểu.
Có những phương pháp nào để đo nồng độ HCl?
Có nhiều cách, từ đơn giản đến phức tạp, tùy thuộc vào độ chính xác cần thiết:
- Đo tỷ trọng (hoặc khối lượng riêng): Dung dịch HCl đậm đặc thường nặng hơn dung dịch loãng. Bằng cách đo tỷ trọng của dung dịch (so với nước), người ta có thể ước tính nồng độ. Phương pháp này khá nhanh nhưng không chính xác bằng các phương pháp hóa học.
- Sử dụng các chỉ thị màu (đo pH): Axit làm thay đổi màu của một số chất gọi là chỉ thị. Độ đậm màu hoặc màu cụ thể có thể cho biết mức độ axit mạnh đến đâu (độ pH), từ đó có thể ước tính nồng độ nếu dung dịch chỉ chứa HCl.
- Phương pháp chuẩn độ (phương pháp hóa học chính xác nhất): Đây là phương pháp phổ biến và chính xác nhất trong phòng thí nghiệm để xác định nồng độ của một dung dịch HCl. Nó dựa trên phản ứng trung hòa giữa axit và một bazơ (kiềm) có nồng độ đã biết chính xác.
Chúng ta sẽ cùng tìm hiểu kỹ hơn về phương pháp thứ 2 và 3, vì chúng giúp ta hiểu sâu hơn về bản chất hóa học.
Phương Pháp Đơn Giản Nhất: Chỉ Thị Màu Để Ước Tính Nồng Độ (Thông Qua pH)
Bạn còn nhớ giấy quỳ tím không? Giấy quỳ tím là một loại chỉ thị màu rất phổ biến. Khi nhúng vào dung dịch axit, nó chuyển sang màu đỏ. Nhúng vào dung dịch bazơ (kiềm), nó chuyển sang màu xanh. Với dung dịch trung tính (như nước), nó giữ nguyên màu tím. Mức độ đỏ đậm hay nhạt có thể cho biết độ mạnh của axit (độ pH thấp là axit mạnh, độ pH cao là bazơ mạnh, pH 7 là trung tính).
Dùng giấy quỳ tím hoặc nước bắp cải để xem “sức mạnh”
Giấy quỳ tím chỉ cho biết dung dịch đó là axit, bazơ hay trung tính. Để ước tính nồng độ axit (hoặc bazơ) chính xác hơn, người ta dùng các loại giấy chỉ thị vạn năng (pH paper) hoặc dung dịch chỉ thị lỏng. Các loại này cho ra nhiều màu sắc khác nhau tương ứng với các giá trị pH cụ thể (từ 1 đến 14). pH càng thấp (ví dụ pH 1, 2) thì axit càng mạnh (nồng độ càng cao). pH càng cao (ví dụ pH 13, 14) thì bazơ càng mạnh.
{width=800 height=800}
Tuy nhiên, có một điều cần lưu ý khi dùng chỉ thị màu để xác định nồng độ của một dung dịch HCl: phương pháp này chỉ ước tính pH. Để suy ra nồng độ chính xác, cần phải biết rõ dung dịch đó chỉ chứa HCl và nước, và dùng bảng chuyển đổi pH sang nồng độ mol hoặc nồng độ phần trăm. Với HCl là axit mạnh, ở nồng độ loãng, pH có thể cho một cái nhìn tương đối về nồng độ. Nhưng phương pháp này thường không đủ chính xác cho các mục đích chuyên môn.
Có một “chỉ thị” tự nhiên rất thú vị mà bạn có thể thử nghiệm tại nhà (luôn có sự giám sát của người lớn và chỉ với các chất an toàn như giấm, nước chanh, nước xà phòng loãng): đó là nước ép bắp cải tím! Nước bắp cải tím chuyển sang màu đỏ/hồng trong môi trường axit, màu tím/xanh dương trong môi trường trung tính, và màu xanh lá/vàng trong môi trường kiềm. Mức độ đậm nhạt của màu cũng có thể cho bạn biết “sức mạnh” tương đối.
- Thí nghiệm vui tại nhà (luôn có bố mẹ nhé!)
- Ép lấy nước bắp cải tím.
- Chuẩn bị vài ly nhỏ chứa nước lọc.
- Thêm vào mỗi ly một ít: nước chanh, giấm, nước rửa chén pha loãng, nước đường, nước muối.
- Nhỏ vài giọt nước bắp cải tím vào từng ly và quan sát sự đổi màu. So sánh màu sắc để thấy sự khác biệt về độ axit/kiềm.
- Lưu ý: Tuyệt đối không sử dụng bất kỳ hóa chất nguy hiểm nào, kể cả HCl, cho thí nghiệm này tại nhà! Chỉ dùng các vật liệu an toàn trong nhà bếp.
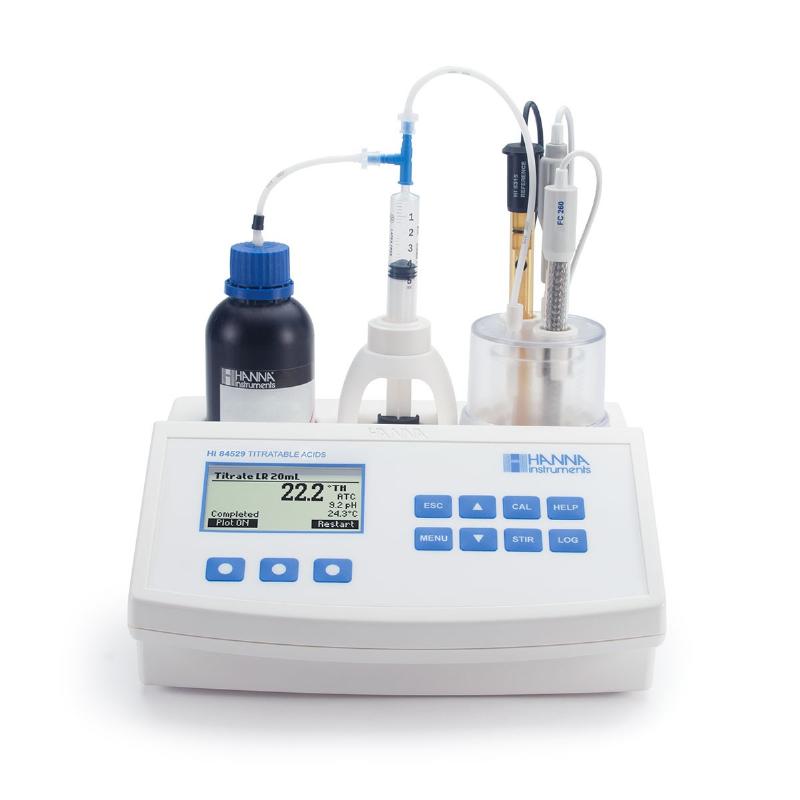
Chuẩn Độ: Cách “Đo Lường” Chính Xác Hơn Trong Phòng Thí Nghiệm
Đây là phương pháp được sử dụng rộng rãi nhất trong các phòng thí nghiệm hóa học để xác định nồng độ của một dung dịch HCl một cách chính xác. Tên gọi của nó là “chuẩn độ axit-bazơ”.
Nguyên lý hoạt động của chuẩn độ là gì?
Tưởng tượng bạn có một lượng nước chanh (axit citric) và muốn biết nó chua đến mức nào (nồng độ axit). Bạn có một bình chứa nước đường (bazơ yếu) đã biết rõ nồng độ. Bạn nhỏ từ từ nước đường vào nước chanh, khuấy đều. Khi nào thì dừng lại? Khi nước chanh không còn chua nữa, tức là axit đã được trung hòa hết bởi bazơ.
Trong chuẩn độ hóa học, người ta dùng một dung dịch có nồng độ đã biết rất chính xác, gọi là “dung dịch chuẩn”. Để để xác định nồng độ của một dung dịch HCl, người ta thường dùng dung dịch bazơ chuẩn, ví dụ như dung dịch NaOH (natri hidroxit) có nồng độ đã biết.
{width=800 height=600}
Quy trình chuẩn độ cơ bản:
- Lấy một lượng chính xác dung dịch HCl cần xác định nồng độ: Người ta dùng dụng cụ đo chính xác như pipet để lấy một thể tích cố định, ví dụ 10 ml dung dịch HCl. Dung dịch này được cho vào một bình tam giác (Erlenmeyer flask).
- Thêm chất chỉ thị: Nhỏ vào bình tam giác vài giọt chất chỉ thị màu phù hợp cho chuẩn độ axit-bazơ, ví dụ phenolphthalein. Phenolphthalein không màu trong môi trường axit và trung tính, nhưng chuyển sang màu hồng trong môi trường bazơ.
- Nhỏ từ từ dung dịch bazơ chuẩn: Dung dịch NaOH chuẩn được cho vào một dụng cụ hình ống có chia vạch rất chính xác gọi là buret. Từ từ nhỏ từng giọt dung dịch NaOH từ buret xuống bình tam giác chứa HCl và chỉ thị. Vừa nhỏ vừa lắc đều.
- Quan sát điểm cuối: Tiếp tục nhỏ NaOH cho đến khi dung dịch trong bình tam giác đột ngột chuyển sang màu hồng nhạt bền vững (không biến mất khi lắc). Đây là “điểm cuối” của chuẩn độ, cho biết lượng axit đã vừa đủ phản ứng hết với bazơ.
- Đọc thể tích bazơ đã dùng: Đọc vạch chia trên buret để biết chính xác thể tích dung dịch NaOH chuẩn đã sử dụng.
- Tính toán nồng độ HCl: Dựa vào thể tích và nồng độ của dung dịch NaOH chuẩn đã dùng, cùng với thể tích dung dịch HCl ban đầu, người ta áp dụng công thức hóa học để tính ra nồng độ chính xác của dung dịch HCl. Phản ứng hóa học cơ bản là: HCl + NaOH -> NaCl + H2O (Axit + Bazơ -> Muối + Nước).
Trích dẫn từ chuyên gia giả định: “Việc chuẩn độ là một kỹ thuật cơ bản nhưng vô cùng mạnh mẽ trong hóa học phân tích. Nó cho phép chúng ta để xác định nồng độ của một dung dịch HCl hoặc nhiều chất khác với độ chính xác cao, điều này rất quan trọng trong kiểm soát chất lượng, nghiên cứu khoa học, và đảm bảo an toàn,” Tiến sĩ Nguyễn Văn An, một chuyên gia hóa học tại Trung tâm Nghiên cứu Ứng dụng Hóa học cho biết.
Chuẩn độ cần sự khéo léo và chính xác trong phòng thí nghiệm. Nó đòi hỏi dụng cụ chuyên dụng và người thực hiện phải có kiến thức về hóa học. Đây không phải là điều chúng ta có thể tự làm tại nhà một cách an toàn và chính xác.
An Toàn Là Trên Hết Khi Nói Về Hóa Chất!
Dù chúng ta đang tìm hiểu về cách để xác định nồng độ của một dung dịch HCl chỉ để hiểu thêm, nhưng việc nói về HCl luôn phải đi kèm với sự cẩn trọng về an toàn. Đây là điều quan trọng nhất, đặc biệt khi chúng ta nói chuyện với các bạn nhỏ qua “Nhật Ký Con Nít”.
- Không bao giờ được tự ý tiếp xúc với hóa chất lạ: Đặc biệt là các hóa chất ghi nhãn cảnh báo nguy hiểm. Luôn có người lớn đi cùng và chỉ tiếp xúc dưới sự hướng dẫn của người có chuyên môn.
- HCl đậm đặc cực kỳ nguy hiểm: Gây bỏng nặng cho da, mắt, và đường hô hấp. Hơi HCl cũng rất độc. Tuyệt đối không được tự ý sử dụng hoặc lưu trữ.
- Dung dịch HCl loãng vẫn cần cẩn trọng: Ngay cả ở nồng độ loãng, HCl vẫn có tính axit và có thể gây kích ứng. Luôn đọc kỹ nhãn mác sản phẩm tẩy rửa (nếu có chứa HCl) và tuân thủ hướng dẫn sử dụng, mang găng tay, kính bảo hộ nếu cần.
- Lưu trữ hóa chất an toàn: Nếu gia đình có sử dụng hóa chất (dù là nước tẩy bồn cầu), hãy đảm bảo chúng được cất giữ xa tầm tay trẻ em, ở nơi khô ráo, thoáng mát, và đậy kín nắp. Không bao giờ đựng hóa chất vào chai lọ thực phẩm.
- Khi gặp sự cố: Nếu chẳng may bị dính hóa chất, rửa ngay dưới vòi nước chảy mạnh trong nhiều phút và tìm kiếm sự trợ giúp y tế ngay lập tức.
{width=800 height=1067}
Hiểu biết về hóa chất và nồng độ của chúng giúp chúng ta biết cách bảo vệ bản thân và những người xung quanh. Việc để xác định nồng độ của một dung dịch HCl là công việc của các nhà khoa học, nhưng việc hiểu tại sao họ làm vậy và tầm quan trọng của nó trong cuộc sống là điều mà ai cũng nên biết.
Tại Sao Cần Biết Nồng Độ HCl Trong Đời Sống?
Ngoài lý do an toàn đã nói ở trên, việc biết nồng độ HCl còn có nhiều ứng dụng thực tế khác mà có thể bạn chưa nghĩ đến:
- Trong công nghiệp thực phẩm: HCl được sử dụng để điều chỉnh độ pH trong sản xuất một số loại thực phẩm, ví dụ như siro ngô, nước giải khát. Việc kiểm soát nồng độ rất chặt chẽ để đảm bảo an toàn và chất lượng sản phẩm.
- Xử lý nước: HCl được dùng để điều chỉnh độ pH của nước trong các nhà máy xử lý nước hoặc bể bơi.
- Sản xuất các hóa chất khác: HCl là nguyên liệu thô quan trọng để sản xuất nhiều hóa chất hữu ích khác.
- Nghiên cứu khoa học: Trong phòng thí nghiệm, việc sử dụng HCl ở nồng độ chính xác là điều kiện tiên quyết cho nhiều thí nghiệm và nghiên cứu.
- Y học: Như đã nói, HCl là thành phần chính của axit dạ dày. Trong một số trường hợp y tế, nồng độ axit dạ dày cần được kiểm tra.
Hiểu được để xác định nồng độ của một dung dịch HCl quan trọng như thế nào trong các lĩnh vực này giúp chúng ta thấy hóa học không chỉ là lý thuyết trong sách vở, mà còn ứng dụng rất nhiều vào đời sống.
Các “Mẹo” Nhỏ Giúp Hiểu Thêm Về Nồng Độ (Với Vật Liệu An Toàn)
Mặc dù không thể tự mình để xác định nồng độ của một dung dịch HCl bằng các phương pháp chính xác tại nhà, chúng ta vẫn có thể thực hiện một số thí nghiệm đơn giản và an toàn để củng cố khái niệm về nồng độ và cách các chất phản ứng với nhau.
- Pha loãng màu thực phẩm: Lấy một cốc nước, nhỏ một giọt màu thực phẩm. Quan sát màu sắc. Thêm nước vào cốc đó, màu sắc sẽ nhạt đi. Đây là minh họa rõ ràng nhất về việc pha loãng làm giảm nồng độ. Bạn có thể thử nhỏ thêm giọt màu nữa để thấy nồng độ tăng lên.
- Thử độ chua của giấm pha loãng: Chuẩn bị vài cốc. Cốc 1: giấm nguyên chất. Cốc 2: giấm pha loãng một nửa với nước. Cốc 3: giấm pha loãng 1 phần giấm, 3 phần nước. Nếm thử (một chút xíu thôi nhé!) hoặc dùng nước bắp cải tím để so sánh độ chua (độ pH). Bạn sẽ thấy cốc nào càng pha loãng thì càng ít chua (nồng độ axit càng thấp, pH càng cao).
- Sự hòa tan của muối/đường: Thử hòa tan 1 muỗng đường vào một cốc nước, rồi 2 muỗng vào cốc khác có cùng lượng nước. Cốc nào ngọt hơn? Đó là cốc có nồng độ đường cao hơn. Tiếp tục thêm đường vào cốc 2 cho đến khi đường không thể tan thêm được nữa – đó là dung dịch bão hòa, một giới hạn về nồng độ.
{width=800 height=534}
Những thí nghiệm nhỏ này giúp chúng ta hiểu rằng nồng độ là một khái niệm linh hoạt và có thể thay đổi thông qua việc thêm chất tan hoặc thêm dung môi.
Kết Luận
Vậy là chúng ta đã cùng nhau khám phá thế giới của nồng độ, đặc biệt là tìm hiểu về cách cơ bản để xác định nồng độ của một dung dịch HCl. Từ việc pha nước cam hàng ngày đến những kỹ thuật phức tạp trong phòng thí nghiệm, khái niệm nồng độ luôn hiện diện và đóng vai trò quan trọng.
Chúng ta đã biết rằng có nhiều cách để ước tính hoặc đo lường nồng độ, từ đơn giản bằng chỉ thị màu cho đến phức tạp và chính xác hơn bằng phương pháp chuẩn độ. Quan trọng nhất, chúng ta đã luôn nhấn mạnh về tầm quan trọng của an toàn khi tiếp xúc với hóa chất.
Việc hiểu về nồng độ không chỉ giúp chúng ta học tốt hơn môn hóa học ở trường, mà còn giúp chúng ta trở thành những người tiêu dùng thông thái hơn, biết cách sử dụng các sản phẩm trong nhà một cách an toàn và hiệu quả.
Hy vọng bài viết này đã mang lại cho bạn những kiến thức bổ ích và thú vị. Đừng ngần ngại thử các thí nghiệm an toàn tại nhà (dưới sự giám sát của bố mẹ nhé!) để củng cố sự hiểu biết của mình. Và nếu có bất kỳ câu hỏi nào về để xác định nồng độ của một dung dịch HCl hay bất kỳ mẹo vặt khoa học nào khác, hãy chia sẻ với “Nhật Ký Con Nít” nhé! Chúng ta sẽ cùng nhau khám phá thêm nhiều điều hay ho nữa!
